近日,我校化学化工学院教师谷慧副教授发现应激颗粒可促进同型囊泡融合。该研究成果以“Amperometry and Electron Microscopy show Stress Granules Induce Homotypic Fusion of Catecholamine Vesicles”为题发表在国际顶级期刊《Angew. Chem. Int. Ed.》上,该期刊为化学领域的经典Top期刊(影响因子:16.6)。该研究工作主要由谷慧副教授(第一作者)和哥德堡大学合作导师Andrew Ewing(通讯作者)共同完成,湖南科技大学为第一单位。

应激颗粒(SG) 是最具有特征的非膜细胞器之一,当细胞暴露于亚砷酸盐、紫外线等应激时,在细胞质中形成。应激会诱导整体翻译停滞,导致核糖核蛋白(RNP)在细胞质中积累再通过液-液相分离(LLPS)组装成SG。这一过程是由易于聚集的RNA 结合蛋白(RBP) 和本质无序蛋白(IDP) 促进的,这些蛋白质通过G3BP1 促进的LLPS 事件凝结成SG,G3BP1 充当介导RNA 和蛋白质SG 成分之间多价相互作用的开关。这些类似液体的SG 包含具有高浓度RBP 的核心区域和围绕核心的浓度较低的壳,这些壳被认为更具活力且交换迅速。据报道,SG 动态紊乱是几种常见神经退行性疾病(ND) 的主要驱动因素,包括肌萎缩侧索硬化症(ALS)、额颞叶变性(FTD)、阿尔茨海默病(AD) 和帕金森病(PD)。SG 是动态的,并在应力消除后溶解,以允许翻译恢复。在这些ND 中,SG 通路被发现反应过度且寿命较长,导致持续或异常SG 的组装。多项证据表明,神经递质释放的破坏是这些ND 中普遍存在的致病特征。然而,人们对它们之间的相互作用以及这种相互作用如何影响它们与胞吐通讯过程相关的功能知之甚少。
鉴于我们对SG 和囊泡之间相互作用的了解有限,我们假设细胞中稳定且长寿命的SG 的形成可能会影响细胞内囊泡。在本文中,我们通过分别从新鲜牛肾上腺和亚砷酸盐处理的人骨骨肉瘤上皮(U2OS)细胞中分离嗜铬细胞囊泡和SG来检验我们的假设。
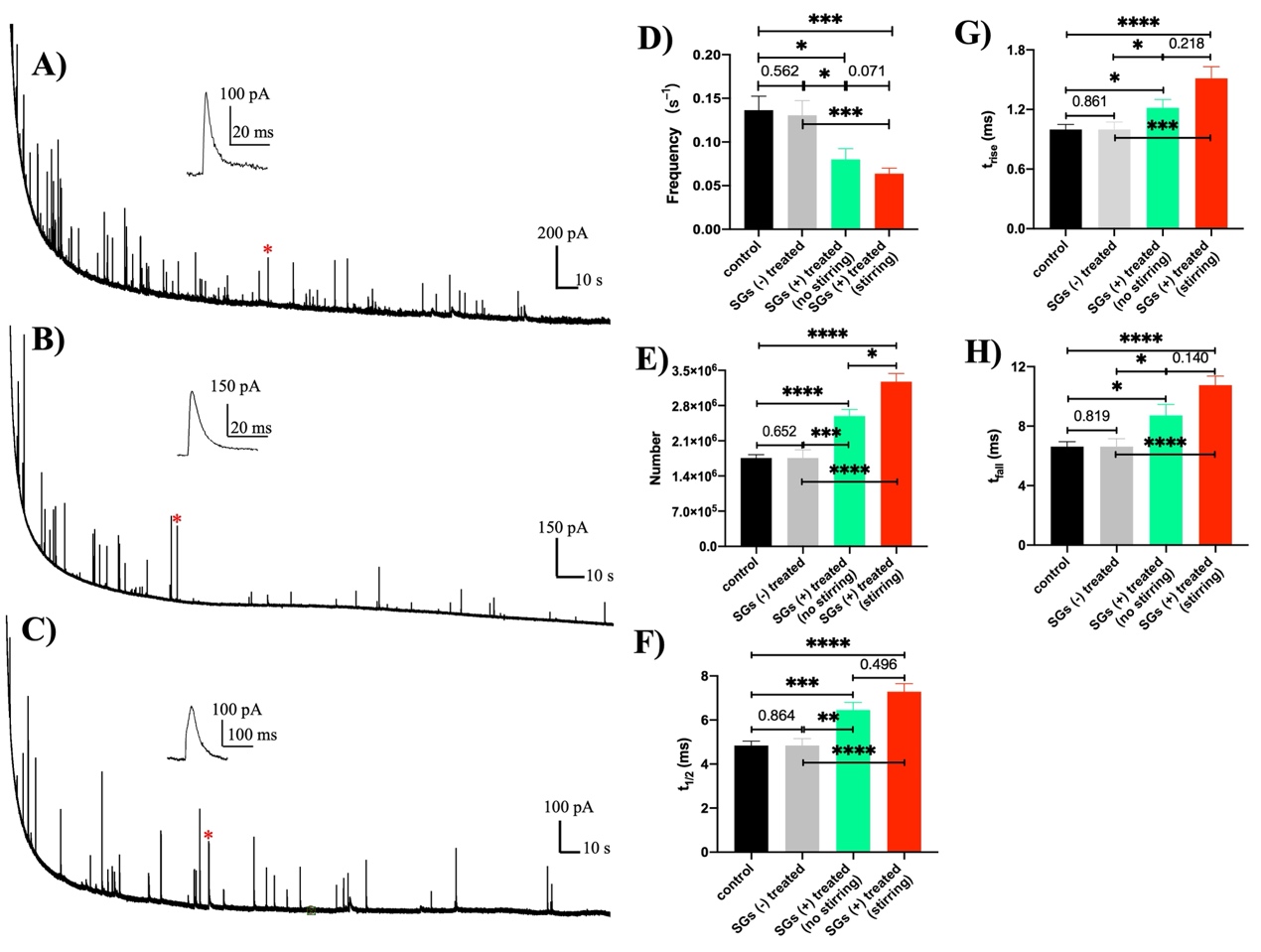
图1.囊泡冲击电化学细胞术结果:(A- C)典型安培电流曲线;(D)囊泡在电极表面的打开频率;
(E)囊泡内的儿茶酚胺数量统计;(F- H)囊泡打开的参数分析
囊泡冲击电化学细胞术结果(图 1A-C)显示,与对照组相比,用SG 处理囊泡并每6 分钟通过吸管搅拌一次后,囊泡打开事件的频率显著降低(图 1D),这种差异似乎归因于SG 和囊泡碰撞所驱动的效应。在SG 处理组和对照组之间,SG处理使囊泡含量显著增加(图1E),且囊泡打开的动力学减慢(图1F-H),这可能是由于附着在囊泡膜上,增加了膜的粘度并减慢了静电能量耗散。
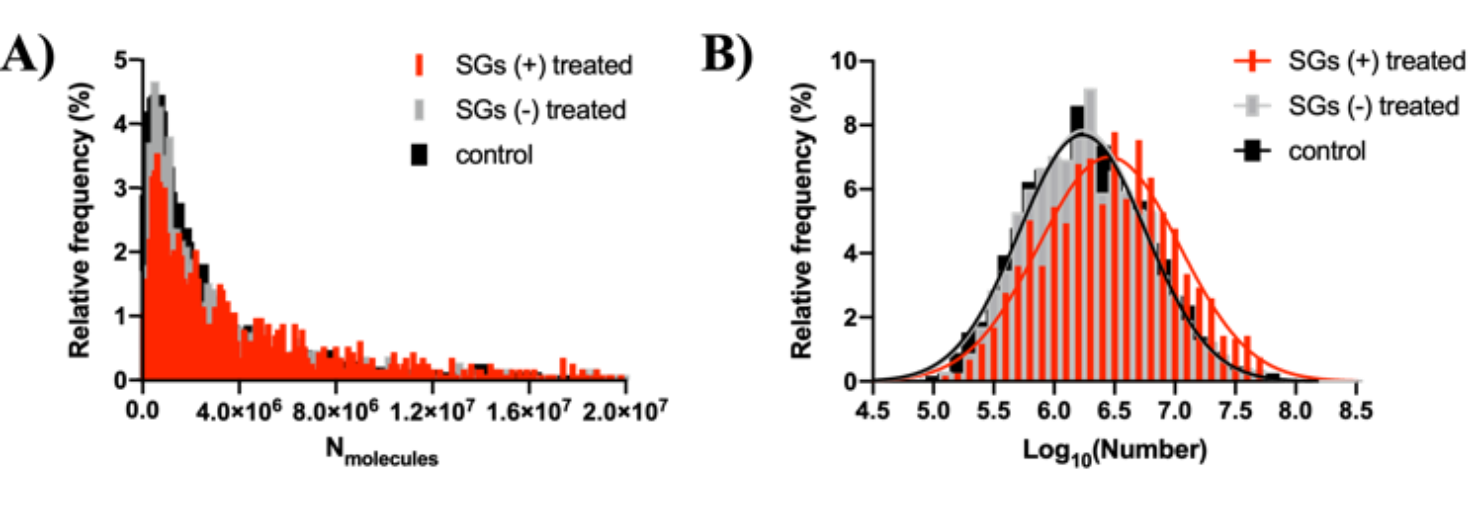
图2. 囊泡打开所有事件的分子数分布
为了弄清楚囊泡内分子数量增加的原因,我们专门分析了囊泡打开所有事件的分子数分布(图2 )证实SG孵育后,形成了部分较大尺寸的囊泡。
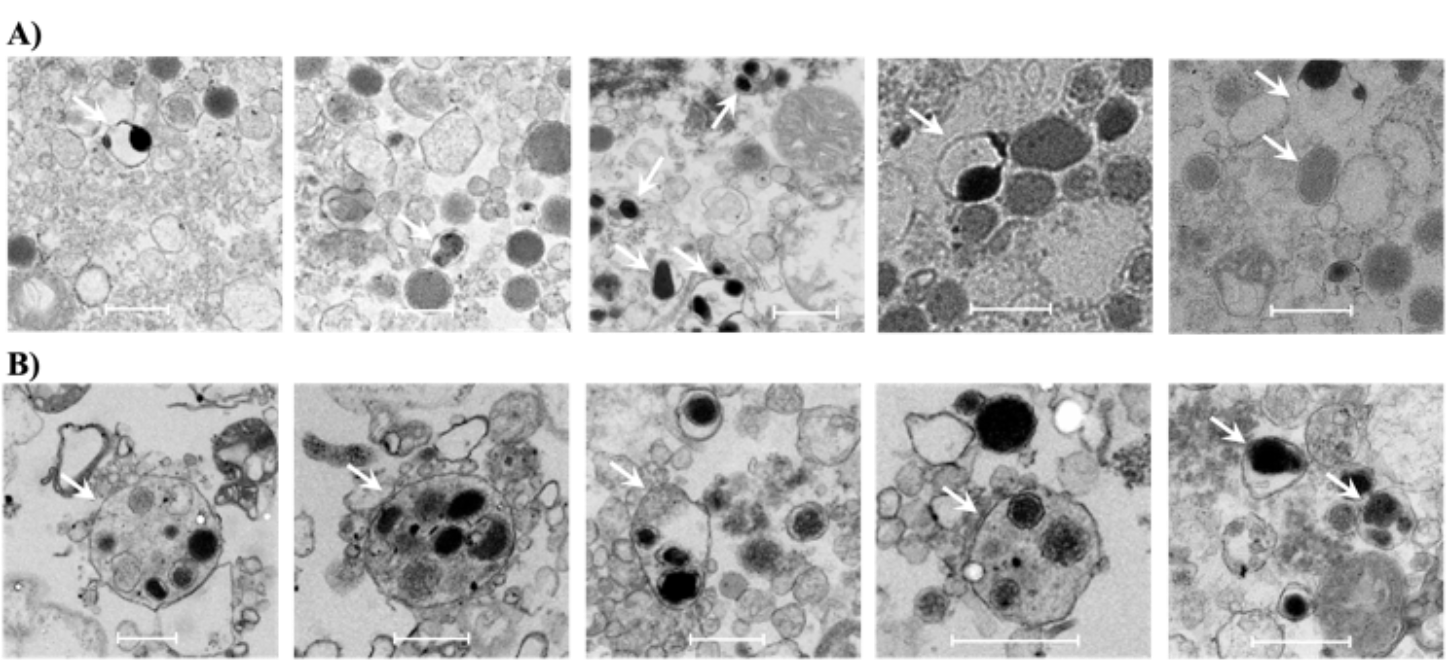
图3. 多核囊泡的TEM图
进一步地,我们通过透射电子显微镜(TEM)清晰地观察到了小部分具有双核/多核的大致密核囊泡(LDCV)(图3),证实SGs诱导LDCV之间的同型融合。这可能是细胞在受到高氧化应激后获得生存的保护步骤。
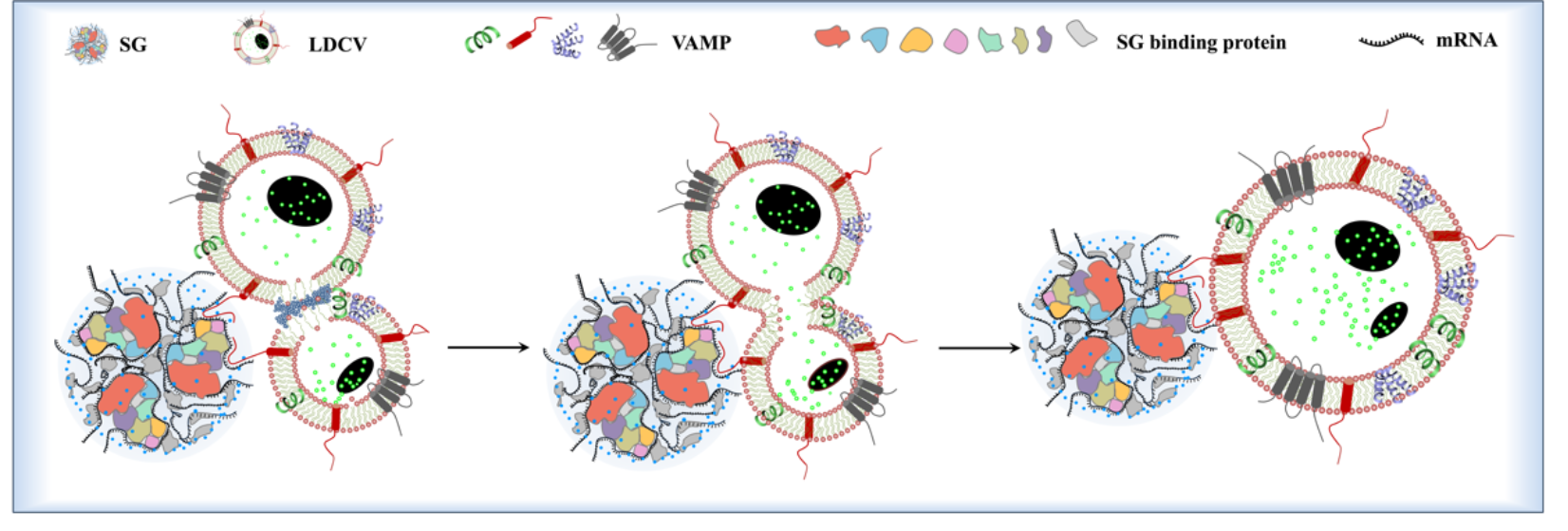
图4. 同型囊泡融合机理推测
本工作中,我们还提出了一种同型融合的假设机制,即SG 外壳中富集的mRNA 或蛋白质可能与囊泡相关膜蛋白(VAMP) 的本质无序蛋白(IDP) 区域结合,驱动两个紧密缠绕的囊泡之间破裂的膜相互融合形成双核囊泡(图4)。
我们的结果表明,SGs 诱导LDCVs 的同型融合,从而更好地理解SGs 如何干预病理过程,并为SGs 涉及神经退行性疾病的研究开辟新方向。
该研究工作得到了欧盟地平线计划“玛丽·居里“人才计划项目的资助。
论文链接为:
https://onlinelibrary.wiley.com/doi/full/10.1002/anie.202400422

